Toksykologja chemicznych środków bojowych/Rozdział X
| <<< Dane tekstu >>> | |
| Autor | |
| Tytuł | Toksykologja chemicznych środków bojowych |
| Podtytuł | z 17 rysunkami oraz atlasem |
| Wydawca | Wojskowy Instytut Naukowo-Wydawniczy |
| Data wyd. | 1925 |
| Druk | Druk J. B. Kondeckiego |
| Miejsce wyd. | Warszawa |
| Źródło | Skany na Commons |
| Inne | Pobierz jako: EPUB Cały tekst |
| Indeks stron | |
Zwrócimy uwagę przedewszystkiem na trucizny narządów oddechowych, jako na środki bojowe, których użycie było początkiem wojny gazowej.
Działanie tych trucizn składa się przedewszystkiem z trzech zasadniczych objawów podrażnienia:
1) zmiany rytmu oddechowego, aż do wstrzymania oddechu w okresie wydechu;
2) skurczu mięśni głośni;
3) całego szeregu odruchów ochronnych, przedewszystkiem kaszlu skurczowego.

Rys. 11.
Aparat Mayer’a do badań skutków podrażnienia górnych dróg oddechowych. Do tchawicy zwierzęcia (królika) wstawiono dwie rurki: jedna w kierunku do płuc, druga do górnych części narządów oddechowych. Obie rurki połączono z dużą butlą A. napełnioną czystem powietrzem. Rurka połączona z płucami otwiera się swobodnie, na rurkę zaś połączoną z górnemi oddziałami, przymocowano pęcherz gumowy B. Do tego naczynia idzie rurka C połączona z wymienionym przyrządem Mayer’a celem otrzymania krzywej oddechu. Na pysk zwierzęcia nałożono maskę respiracyjną, połączoną z naczyniem D, zawierającem odpowiednią mieszaninę powietrza i trującego środka, do którego biegnie stały prąd powietrza z gazomierza.
Do tchawicy zwierzęcia (królika) wstawiamy dwie, zagięte pod prostym kątem rurki, jedną w kierunku płuc, drugą w kierunku jamy ustnej. Do tej ostatniej dołącza się duży gumowy pęcherz, z cienkiemi ściankami, znajdujący się w dużem naczyniu ze szkła, do którego przez ten sam korek doprowadzona jest druga rurka, która otwiera się bezpośrednio wewnątrz tego naczynia. Oczywiście, że ujemne ciśnienie, powstałe wskutek wdechu, wywoła rozszerzenie pęcherza, a więc pewien prąd powietrza przez górne drogi oddechowe jamę nosową, gardziel i krtań. Wydech, wywołując w naczyniu dodatnie ciśnienie, kieruje prąd powietrza w odwrotnym kierunku. Jeżeli postawimy koło pyska zwierzęcia maskę do usypiania, zwilżoną odpowiednim płynem, albo lepiej, jeżeli głowa tego zwierzęcia będzie się znajdowała w pęcherzu gumowym szczelnie przylepionym do szyi, przez który przepuszczano prąd powietrza ze stałem stężeniem badanej trucizny, będziemy mieli warunki, w których do płuc i oskrzeli (dolnych części, leżących poniżej krtani) może się dostać tylko niezatrute powietrze, a wszystkie obserwowane zjawiska będą zależne wyłącznie od podrażnienia górnych dróg oddechowych. W ciągu długotrwałych doświadczeń ilość powietrza, znajdująca się w naczyniu, może być za mała wskutek czego powstanie nagromadzenie CO2 i brak tlenu. Ażeby temu zapobiec do przyrządu dołącza się system zastawek, dzięki któremu prąd powietrza jest możliwy tylko w jednym kierunku, a nadto płuczkę z rozczynem ługu dla pochłaniania CO2 i gazomierz z tlenem, który podtrzymuje stałość objętości powietrza, zawartego w naczyniu.
Dzięki przeprowadzonym tak doświadczeniom ustalono, że omówione objawy rzeczywiście są skutkiem podrażnienia dróg górnych i powstają niezależnie od bezpośredniego działania trucizny na płuca.
Wszystkie te objawy są bardzo łatwe do zrozumienia, jeżeli rozpatrywać je z punktu widzenia przystosowania organizmu do nienormalnych warunków. Mają one na celu zapobieżenie dostarczeniu do płuc większych ilości trucizny, wskutek czego powstają zmiany rytmu oddechu w postaci — od wyraźnego zwolnienia, z krótkotrwałym wdechem i długim wydechem, aż do powstania tak zw. duszności wydechowej i zatrzymania oddechu wskutek skurczu wydechowego. Ta sama przyczyna wywołuje skurczowe zamknięcie głośni, którego celem jest niedopuszczenie zatrutego powietrza do czułych pęcherzyków płucnych. Ponieważ takie zabiegi ze strony ustroju nie zawsze są zupełnie skuteczne pewna ilość drażniącego środka przenika wkońcu poniżej krtani, a ponadto powstają jeszcze inne odruchy ochronne, których celem jest wyrzucenie trucizny z płuc — kaszel, a wskutek rozpromienienia tego odruchu — wymioty.
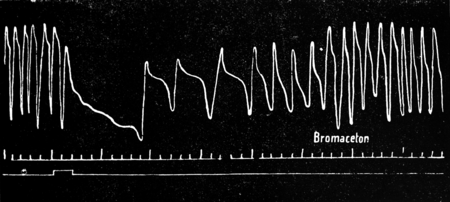
Rys. 12.
Krzywa oddechowa przy podrażnieniu górnych dróg oddechowych bromacetonem w ciągu 2″. Odrazu nastąpiło zatrzymanie oddechu, a następnie wyraźne zwolnienie jego przy zmniejszeniu objętości oddechowej.
Odruchy narządów oddechowych powstają w ściśle określonej kolejności. Jako pierwsza oznaka podrażnienia występuje zahamowanie i nawet chwilowe zatrzymanie ruchów oddechowych, następnie powstają ataki kaszlu, a jako najwyższy stopień rozwoju objawów podrażnienia — skurcz głośni i skurczowy bardzo mocny wydech.
Połączone z temi zmianami w czynności narządów oddechowych zmiany krążenia, podniesienie ciśnienia w żyłach, podniesienie a następnie spadek ciśnienia w tętnicach i osłabienie czynności serca, są wyraźnemi typowemi objawami tego rodzaju duszności. W pewnych, chociaż bardzo rzadkich wypadkach, podniesienie ciśnienia w klatce piersiowej, wskutek skurczowego czynnego wydechu przy zamkniętej głośni, może dosięgać tego stopnia, że serce nie jest już zdolne do napełnienia się krwią w czasie rozkurczu. Skutkiem tego następuje nagła niedokrwistość mózgu, utrata przytomności i nawet natychmiastowa śmierć. Na sekcji, w tych przypadkach nie można znaleźć żadnych zmian anatomicznych. Jest to jedna z typowych cech nagłej śmierci w zatruciu środkami tej grupy.
Zdolność do podrażnienia górnych dróg oddechowych jest cechą całego szeregu środków bojowych. Mocne środki odruchowe nie zawsze są również mocnemi środkami oddechowemi i naodwrót. Wogóle najlepiej zbadane co do napastliwości trucizny oddechowe można przedstawić w postaci następującego szeregu środków wzrastającej czynności. Zupełnie niedrażniące: siarkowodór i siarczek węgla. Mało drażniące: tiofosgen, kwas pruski i bromek benzylu. Mocno drażniące czyli niewdychalne: chlor, fosgen, chlorosiarczan etylu, akroleina, bromaceton, palit i brommetyloetyloketon.
Wszystkie środki działające na narządy oddechowe mogą wywoływać zapalenia, a w większych stężeniach martwicę tkanek, z któremi się bezpośrednio stykają. Dlatego w każdem dostatecznie długotrwałem działaniu tych trucizn powstają mniej więcej poważne zapalenia spojówki, katar jamy nosowej i gardzielowej i w dalszym ciągu zapalenia krtani, tchawicy, oskrzeli i wreszcie samych płuc. Ponieważ zmiany głębokich części narządów oddechowych są stałemi skutkami zatruć truciznami płucnemi i nawet różnica pomiędzy truciznami górnych dróg, a truciznami płucnemi jest przedewszystkiem oparta na wynikach badań anatomicznych, rozpatrzymy szczegóły tych zmian dla wszystkich trucizn oddechowych razem.
Działanie trucizn oddechowych na płuca i oskrzela jest możliwe tylko wskutek niewystarczalności narządów ochronnych i przesączania się powietrza, zawierającego wyżej omówione trucizny niewdychalne, poniżej krtani, albo wskutek tego, że dana trucizna, mogąc wywoływać miejscowe zmiany anatomiczne, nie jest dostatecznie drażniąca, żeby wywołać odpowiednie odruchy ochronne. Pierwsze jest niezbędne w takich warunkach, gdzie człowiek nie jest w stanie usunąć się natychmiast z zatrutego środowiska.
W doświadczeniach ze zwierzętami bezpośrednie działanie na głębokie części narządów oddechowych daje się łatwo uskutecznić przy pomocy tracheotomji t. j. wstawiania w tchawicę odpowiedniego kształtu rurki metalowej, otwierającej się bezpośrednio nazewnątrz i połączonej z źródłem zatrutego powietrza.

Rys. 13.
Krzywa oddechowa przy dostarczeniu pary fosgenu do głębokich części aparatu oddechowego. Wdmuchiwanie powietrza zawierającego fosgen przez kaniulę tchawiczną w ciągu 31/2 sekund wywołało odrazu przyspieszenie oddechu i zmniejszenie objętości oddechowej.
Dostarczenie tych trucizn do głębokich części narządów oddechowych wywołuje również szereg odruchów, mających jednak nieco inny charakter i jako skutek bezpośredniego działania na ścianki małych oskrzeli, skurcz ich mięśni, zdolny w pewnych wypadkach wywoływać w części ich zupełne nawet zamknięcie. Objawy zapalenia i toksycznego obrzęku płuc, najważniejszej ze zmian w zatruciu głębokich części dróg oddechowych, są w wypadkach bezpośredniego działania dużych ilości trucizny bardzo wyraźne.
Co do szczegółów takich zatruć specjalnemi truciznami płucnemi albo wogóle objawów przeniknięcia jakichkolwiek trucizn oddechowych do płuc, to pierwszym i najbardziej stałym symptomem bywa znaczne przyspieszenie rytmu oddechu, który staje się też więcej powierzchownym. Jest to wyrazem dążenia ustroju do najprędszej wentylacji płuc. Jednoczesny skurcz mięśni oskrzeli wytwarza jednak znaczny opór w przechodzeniu powietrza do pęcherzyków płucnych i dlatego, odwrotnie do tego, co mieliśmy na krzywej oddechu przy podrażnieniu górnych dróg, mamy w danym wypadku przedłużony wdech, a nie wydech.
Szereg napastliwości trucizn w stosunku do dolnych dróg oddechowych jest zupełne inny niż dla górnych. Najmniej czynnemi okazują się chlorosiarczan etylu i bromometyloetyloketon, które należały do najmocniejszych. Dalej idą akroleina i palit.
Najczynniejszemi są tlenki azotu i fosgen.
Stopień skurczu oskrzeli w użyciu trucizny można ustalić zapomocą następującego doświadczenia.
Na powierzchni płuc, wyjętych z tylko co zabitego psa, robiono liczne nakłucia ostrą długą igłą w tym celu, aby utworzyć możliwie dużą ilość otworów w ściankach pęcherzyków. Łącząc takie preparowane płuca z gazomierzem, w którym powietrze znajduje się pod pewnem ciśnieniem, otrzymujemy powstanie stałego prądu powietrza np. o 100 cm3 na minutę. Jeżeli do tego wchodzącego do płuc powietrza dodać małą ilość par drażniącego środka, skurcz oskrzeli wywołuje wskutek powiększenia oporu mniej więcej znaczne zahamowanie prądu i ilość powietrza wychodzącego z gazomierza zmniejsza się do 40 — 35 cm3. Stosunek 40/100 będzie wskaźnikiem stopnia zwężenia oskrzeli.
Dolne części narządów oddechowych, znacznie czulsze od górnych, łatwo podlegają zapaleniu, wskutek czego nabrzmiała śluzówka oskrzeli, wydzielająca obficie śluz pomimo skurczu mięśni może stać się o tyle grubą w stosunku do średnicy rurki oskrzelowej, że nastąpi długotrwałe zatkanie tej rurki. W takich wypadkach powietrze, znajdujące się w zraziku płucnym poniżej miejsca zatkania, dość prędko (kilka godzin) wchłania się, tkanka płuc ściąga się i staje się podobną do narządów miąższowych, np. śledziony (splenizacja płuc). Taki stan nazwano niedodmą. Ponieważ płuca znajdują się w przestrzeni o ciśnieniu mniejszem od atmosferycznego, w tych zrazikach, które bezpośrednio łączą się z podległemi niedodmie, ciśnienie wewnętrzne wzrasta w znacznym stopniu i wywołuje ich rozdęcie, a zatem zanik ścianek i tworzenie się dużych pęcherzy, odpowiadających kilkunastu normalnym pęcherzykom. Taki stan rozdęcia płuc, zawsze łączny z niedodmą, zowie się rozedmą zastępczą. Jest to najbardziej typowym objawem anatomicznym w płucach w ostrem zatruciu truciznami oddechowemi.
W razie jeszcze pełniejszego zatkania przez wciąganie kawałeczków obumarłej śluzówki, albo błonek rzekomych z wyżej leżących odcinków dróg oddechowych, niedodma staje się stałą i stopniowo, dzięki procesom zapalnym i martwicy uszkodzonych tkanek, powstaje ściągająca się blizna. Takie blizny pozostają już na zawsze.
Rozedma nie ogranicza się do pęcherzyków, lecz w okolicach uszkodzonej tkanki płucnej, w razie długotrwałego przebiegu, często znajdujemy mniej więcej znaczne jamy, napełnione ropą. Są to rozszerzone oskrzela. Takie zmienione oskrzela nazwano rozdęciem oskrzeli (bronchiektasia). Trzeba odróżniać je od ropników i zgorzeliny płuc, w których ścianki są utworzone z tkanki ziarniowej, jak w każdym innym ropniku i w żadnym wypadku nie są wysłane nabłonkiem.
Co do szczegółów zapalenia narządów oddechowych, to trzeba zauważyć, że po działaniu trucizn bojowych, mamy przeważnie powstawanie wysięku włókninowego, tworzącego obfite błony rzekome w gardzieli, krtani, tchawicy, oskrzelach i nawet we właściwej tkance płuc. W płucach powstaje typowe zapalenie zrazikowe, zwykle obejmujące prawie wszystkie zrazy i bezwzględnie śmiertelne. Jeszcze wcześniej, w początku działania trucizny, albo w takiem stężeniu, które nie jest jeszcze w stanie wywołać powstania wysięku włóknikowego, mamy znaczny stopień obrzęku zapalnego, który powstając w krtani, może też stać się przyczyną nagłej śmierci. W samych płucach takie wzmożenie przesiąkania, a w pewnych truciznach grupy fosgenu nawet swoiste wystąpienie osocza krwi, może stać się źródłem toksycznego obrzęku płuc, napełnienia pęcherzyków płucnych płynem, występującym z naczyń krwionośnych jego ścianek. Teorja tego zjawiska nie jest jeszcze dokładnie ustalona.
Nie ulega wątpliwości, że w pewnych wypadkach mamy tu do czynienia tylko ze zwykłemi skutkami zapalenia w pierwszych okresach jego rozwoju. W drugich znowu wypadkach obrzęk ten jest skutkiem wad krążenia z powodu osłabienia serca. Taki obrzęk płuc obserwowano nawet w działaniu trucizn nie wywierających zwykle żadnego wpływu na narządy oddechowe np. muskariny. Wreszcie znane są przypadki obrzęku płuc, rozwijającego się nagle, o bardzo znacznej ilości płynu obrzękowego, skład którego różni się od zwykłego płynu obrzękowego, i nawet od surowiczych wysięków, tak dalece że wytłumaczenie przyjęte nie wystarcza. Bardziej prawdopodobną wydaje się taka teorja: w normalnych warunkach błonka oddechowa pęcherzyków płucnych jest bezwzględnie nieprzepuszczalną dla płynów i służy tylko do przemian gazowych, nie wyłączając i przesączania się pary wodnej. W razie częściowego uszkodzenia nabłonka oddechowego, staje się on przepuszczalnym dla wysięków zapalnych, ale w niejednakowym stopniu we wszystkich zrazikach, dlatego obrzęk przyjmuje charakter częściowy, nie wykluczający możliwości wykonania czynności oddechowej. W wypadkach, kiedy nabłonek przestaje wykonywać swą czynność wskutek martwicy lub wskutek paraliżu, wywołanego zatruciem, nie przedstawia on już żadnej przeszkody występowania płynów i pęcherzyki natychmiast wypełniają się plazmą krwi, ponieważ w pęcherzykach płucnych zawartość naczyń jest oddzielona od jamki pęcherzykowej cienką warstewką śródbłonka i omówionego wyżej nabłonka oddechowego.
Trucizny, mające właściwość wywoływania takiej nieczynności nabłonka oddechowego, mogą zabijać natychmiast, wywołując tak zw. apoplexia serosa. Zjawisko to jest szczególnie charakterystyczne dla grupy fosgenu.
Ponieważ uszkodzenia nabłonka górnych dróg oddechowych w tych zatruciach są stosunkowo nieznaczne, a nabłonek śluzówki tchawicy może nawet zachowywać swoje rzęski migawkowe, trucizny takie są właśnie prawdziwemi truciznami płucnemi. Wszystkie inne trucizny oddechowe wywołują równocześnie zarówno zmiany w płucach, jak i w górnych drogach oddechowych. Zmiany te wahają się między powierzchownemi uszkodzeniami nabłonka, łatwo potem podlegającego odradzaniu (jak w zatruciach chloropikryną), a zupełną martwicą i odpadnięciem całej śluzówki (zmiany właściwe dla grupy chloru).
Prócz tego w zatruciach środkami oddechowemi nieuniknione są inne zmiany w samych płucach. Ze zmian tych najważniejszemi są: ogólne przepełnienie naczyń płucnych krwią skutkiem zatrzymania krwioobiegu małego i pewna utrata elastyczności płuc (Lungenstarrheit Basza), skutkiem których wytwarzają się porażenie płuc (Lungenblähung) i następnie chroniczna rozedma. Pierwszy z tych stanów jest prawie zwykłym wynikiem działania wszystkich trucizn narządów oddechowych. Przyczyną jego jest po pierwsze niewystarczająca czynność serca, a po drugie zmiany we właściwości tkanki, otaczającej naczynia, polegające na utracie elastyczności. Pewien brak elastyczności, pozostając nawet po uregulowaniu uszkodzeń krwioobiegu, jest znowu przyczyną tego, że w znacznym stopniu powiększa się ilość tak zw. minimalnego powietrza, czyli tej ilości powietrza, która jest zawarta w płucach po wyjęciu ich z klatki piersiowej. Dlatego ciężar gatunkowy takich płuc w wodnej próbie okazuje się mniejszym od normalnego. Podczas sekcji, gdy przednia ścianka klatki piersiowej zostaje usunięta, płuca pozostają tejże samej wielkości, wypełniają całkiem klatkę piersiową, i zakrywają serce, a nie odciągają się, jak zwykle, wtył i do góry.
Równocześnie z temi zmianami prawie we wszystkich wypadkach zatruć truciznami oddechowemi powstaje wyraźne nagromadzenie młodych komórek tkanki łącznej i śródbłonka tak w ściankach pęcherzyków płucnych jak również oskrzelików. Następna organizacja tej tkanki, łącznie z zanikiem swoistych komórek nabłonka oddechowego i migawkowego, powoduje typowe dla toksycznych zapaleń płucnych przewlekłe zmiany — sklerozę (marskość) płuc i broncholitis obliterans czyli zarośnięcie oskrzelików. Zmiany te są najwięcej wyraźne w zatruciach chlorem.
Wszystkie omówione zmiany stanowią bezpośredni skutek zatrucia i w znacznym stopniu mogą być zauważone natychmiast. Po upływie kilku dni do tych zmian dołączają się zwykle liczne zmiany następne, zależne od zakażenia uszkodzonych płuc drobnoustrojami. Nieżyt oskrzeli, zapalenie płuc, zmiany w miejscach dotkniętych niedodmą — przybierają charakter procesów ropnych, wywołanych najczęściej gronkowcami albo paciorkowcami, a w znacznej ilości wypadków typowemi drobnoustrojami zrazikowego zapalenia płuc — dwoinkami płucnemi. W pewnych wypadkach powstaje nawet typowa zgorzelina płuc, wywołana anaerobami. Zwykle są to laseczki wrzecionowate Vincent’a łącznie z krętkami.
Wszystkie te drobnoustroje, które są źródłem zakażenia płuc, pochodzą bezwątpienia z jamy ustnej. Wysięk zapalny i obumarła tkanka przedstawiają dla nich bardzo wygodne warunki istnienia; powikłania te wywołują przeważną część tak zw. śmierci odległych, w ciągu 2-3 tygodni po zatruciu.
W Używane dotychczas trucizny oddechowe można podzielić według ich właściwości toksykologicznych i chemicznych na następujące grupy.
A. Grupa chemicznych środków z działaniem podobnem do działania chloru. Charakterystyczną ich cechą jest stosunkowo niewielka jadowitość wobec wyraźnych uszkodzeń dróg oddechowych. Ta grupa składa się:
1) z chlorowców: chlor i znacznie słabszy co do czynności brom i jod.
2) Grupa organicznych pochodnych siarki: siarczan metylowy SO2(OCH3), chlorosiarczan metylu SO2Cl(OCH3) (vaillantite), chlorosiarczan etylu SO2Cl(OC2H5) (sulvinite).
3) Bezwodnik kwasu siarkowego i dwutlenek siarki SO3 i SO2.
4) Chlorki siarki S2Cl2, SCl2 i SCl4.
B. Grupa fosgenu: chlorobezwodniki kwasów organicznych.
1) Fosgen (bromofosgen i tiofosgen).
2) Pality i superpality.
C. Grupa chloropikryny.
1) Chloropikryna.
2) Akroleina, aldehyd krotonowy, formalina.
D. Grupa tlenków azotu NO, N2O2, N2O4, NO2, N2O5.
E. Grupa dymów bojowych.
1) Dymy obojętne: mieszaniny Bergera, chlorek amonu.
2) Dymy żrące, wytwarzające bezwodniki kwasów nieorganicznych. Fosfor, trójtlenek siarki, chlorek sulfurylu, kwas chlorosulfonowy, chlorek cynowy, chlorek tytanu, chlorek krzemu, chlorek chromilu.
3) Dymy trujące: chlorek arsenu, rozmaite chloroarsyny, mieszaniny Bergera, dające podczas spalania fosgen, mieszaniny chlorku cyny z kwasem pruskim, chloropikryną i fosgenem, mieszaniny chlorku arsenu z fosgenem.
F. Grupa amoniaku.
Znaczna część omówionych środków nigdy nie miała wielkiego znaczenia i próby używania tych środków należą do pierwszych okresów rozwoju broni chemicznej. Tak liczne pochodne siarki, pomimo wyraźnych właściwości żrących i mocnego działania na górne drogi oddechowe, pozostały prawie bez użycia, chociaż estry kwasu siarczanego, a szczególnie siarczan metylu są nietylko truciznami oddechowemi, lecz też potężnemi truciznami ogólnemi. Siarczan metylu np. powoduje u zwierząt głęboką śpiączkę, oraz ataki skurczowe.
Pochodnych (estrów) kwasu chloro-sulfonowego używali Francuzi do napełniania pocisków. Zasadniczą właściwością tych środków jest wywoływanie toksycznych zapaleń płuc. Bezwodnik kwasu siarczynego SO2, pierwszy z używanych gazów bojowych, jest znacznie mniej jadowity niż inne środki, nawet niż chlor. Był on oddawna używany dla celów taniej dezynfekcji i niszczenia szkodników, przedewszystkiem w stanie tak zw. gazu claytonowskiego dla deratyzacji (niszczenie szczurów) w okrętach. Jest to ciężki (ciężar gatunkowy 2,2) bezbarwny gaz o nieprzyjemnym duszącym zapachu, znany każdemu. Dość łatwo podlega skropleniu (punkt wrzenia 8°); łatwo jest rozpuszczalny w wodzie (79,8 na litr wody). Powstaje przy spaleniu siarki, albo przy spaleniu mieszaniny spirytusu z siarczkiem węgla, wraz z CO2. Do celów bojowych jest mało użyteczny wskutek zbyt małej jadowitości. Ludzie łatwo wytrzymują obecność jego do 2/M3. Doświadczenia z zatruciem zwierząt na wolnem powietrzu dały wyniki ujemne. Pomimo tego w znacznych stężeniach (kilka %) jest on jednym z najmocniejszych środków odruchowych, mianowicie wywołujących skurcz mięśni głośni i oskrzeli.
Działanie chlorków siarki SCl2 i SCl4 zależy od rozkładu ich na chlor i jednochlorek siarki S2Cl2, więc nie różni się od działania chloru. Jadowitość jednochlorku siarki jest mało zbadana, ale w każdym razie nieznaczna. Lehman zalicza ten związek, używany w znacznych ilościach przy wulkanizacji kauczuku, do substancyj obojętnych.
Z dużej liczby pochodnych kwasu siarczynego i siarkowego rolę środków bojowych odgrywała dość niewielka ilość. Są to po pierwsze nieorganiczne związki zawierające chlor, mianowicie: chlorek sulfurylu SO2Cl2, kwas chlorosulfonowy OH.SO2.Cl, chlorek tionylu SO.Cl2, i chlorek pyrosufurylu Cl2S2O5. Żadny z tych związków nie posiada samodzielnego znaczenia za wyjątkiem kwasu chlorosulfonowego, który używano jako dym bojowy. Są one jednak ciekawe jako stałe domieszki do pewnych trucizn bojowych, mianowicie używanych przez Francuzów w początku wojny gazowej vaillantite i sulvinite. Są to płyny któremi napełniano pociski. Obydwa omówione środki są złożonemi mieszaninami organicznych pochodnych kwasu chlorosiarczanego. Vaillantite jest przeważnie chlorosiarczanem metylu, a sulvinite chlorosiarczanem etylu. Wzory ich są Cl.SO2OCH3 i Cl.SO2OC2H5. Napastliwość tych środków jest bardzo znaczna: vaillantite drażni górne drogi oddechowe w stężeniu 0,06/M3 a sulvinite nawet w stężeniu 0,04/M3. Obydwa są dość mocnemi lakrymatorami i wywołują w płucach zmiany bardzo podobne do obserwowanych w zatruciach chlorem. Zabójcze stężenie dla vaillantite jest 2/M3 dla sulvinite nieco więcej.
Bardzo ciekawym jest z powodu swoich właściwości drażniących należący też do pochodnych kwasu chlorosiarczanego chlorosiarczan trójchlorometylu CCl3O.SO2Cl. Jest to stałe ciało dotychczas jeszcze mało zbadane z punktu widzenia toksykologicznego.
Wśród organicznych pochodnych kwasu siarczanego nie zawierających chloru znajduje się też cały szereg niebezpiecznych trucizn jak to siarczan dwumetylowy (CH3)SO4, i kwas metylosulfonowy CH3SO2OH jak również homologiczne pochodne etylowe. Są to jednak raczej trucizny z działaniem ogólnem i są one w każdem razie mniej drażniące niż związki chlorowane. Przewlekłe zatrucie siarczanem dwumetylu powoduje zapalenie płuc, nawet bez żadnych przejawów natychmiastowych.
Bardzo mało czynnym okazał się amoniak. Próby używania amoniaku były dość liczne. Chociaż obecność tego gazu daje się zauważyć już w stężeniach 0,1/M3, nawet w stężeniu 4/M3, nie wywołuje on jeszcze poważnych skutków i powietrze pozostaje wdychalnem aż do stężenia 200/M3.
Chlor, w porównaniu z innemi środkami bojowemi, jest bardzo słabą trucizną. Dla człowieka niebezpieczne stężenie chloru rozpoczyna się od 6/M3. Koncentracja 10 M3 jest już bezwzględnie śmiertelną. Obecność chloru w powietrzu (według danych Lehmana) można zauważyć od stężenia 0,003/M3, które jest już wyrażnie drażniące i wywołuje w drogach oddechowych uczucie zimna. Stężenie 0,006/M3 wywołuje łzawienie i ślinienie, 0,01/M3 — wyraźny nieżyt dróg oddechowych, 0,03/M3 może wywołać po dłuższem działaniu zmiany w płucach. Według nowszych danych mamy następujące liczby: zapach chloru można zauważyć rozpoczynając od 0,01/M3, podrażnienie górnych dróg następuje w stężeniu 0,48/M3, powietrze staje się niewdychalne, gdy stężenie chloru dosięgnie 0,96/M3. Zabójcze działanie (na psy) obserwowano od 10/M3. Drobne zwierzęta są znacznie czulsze. Świnka morska ginie w stężeniu 2/M3.
Z powodu szeregu właściwości wygodnych do celów wojennych używano chloru w początku wojny z bardzo dodatniemi wynikami. Od użycia chloru w kwietniu 1915 roku na froncie francuskim datuje się rozpoczęcie wojny gazowej.
Chlor jest gazem ciężkim (21/2 razy cięższy od powietrza) żółto-zielonej barwy z charakterystycznym nieprzyjemnym zapachem. Jest on bardzo czynnym chemicznie i łatwo tworzy cały szereg związków. W warunkach podniesienia ciśnienia (przy temperaturze 18° do 16,5 atm.) lub obniżenie temperatury do -34°C (ciśnienie 760 mm) chlor łatwo podlega skropleniu, tworząc płyn (z c. g. 1,46) wrzący o -33,5°C. i zabarwiony na zielono-żółty kolor. Przy -102°C płyn ten przybiera postać blado-żółtej masy. Chlor łatwo rozpuszcza się w wodzie w stosunku 2,15 na 100 wody.
Dzięki właściwości łatwego stężenia, chlor używano tak dla bojowych, jak i dla technicznych celów w postaci płynu zawartego w stalowych bombach. Jest to możliwe dlatego że suchy chlor na żelazo nie działa, gdy w obecności wody powstaje łatwo rozpuszczalny związek Fe2Cl6.
Chlor oddawna otrzymano w dużych ilościach z soli kuchennej. W tym celu z początku otrzymuje się kwas solny, który następnie rozkłada się przy działaniu nadtlenku manganu według wzoru MnO2 + 4HCl = 2H2O + MnCl2 + Cl2. Nadtlenek manganu można otrzymać zpowrotem z pozostałego MnCl2 przez następne obrabianie kredą, wapnem lub tlenkiem magnesu.
Istnieją też sposoby utleniania HCl tlenem powietrza w obecności dwuchlorku miedzi jako katalizatora (sposób Deakon’a); jak również utleniania chlorku magnezu też w prądzie gorącego powietrza. Najwygodniejszym sposobem jest elektroliza stężonego wodnego rozczynu soli kuchennej. Jako wynik takiej elektrolizy mamy na anodzie czysty chlor, a na katodzie wodorotlenek sodu i wodór. W ten sposób otrzymano teraz chlor wszędzie gdzie jest źródło taniej energji elektrycznej.
W organizmie łączy się on przede wszystkiem z wodą według wzoru Cl2 + H2O = HClO + HCl; kwasy te w obecności jonów Na tworzą sole NaCl i NaClO. Ostatnia sól pod wpływem CO2 rozkłada się we krwi w sposób następujący:
2 NaClO + CO2 = Na2CO3 + Cl2 + O
Chlor jest więc mocnym odczynnikiem utleniającym. Reakcje z Cl zachodzą w ustroju bardzo powoli i dlatego podczas sekcji zatrutych chlorem można zawsze zauważyć zapach jego (przeważnie w mózgu) jeszcze po 1 — 2 dniach.
Przy pomocy odpowiednich odczynników — sole talu i odczynnik Fitzgeralda (mieszanina rozczynów żelazocyanku potasu i cytrinianu żelaza) udało się ustalić iż w razie śmiertelnych zatruć chlorem w naczyniach krwionośnych płuc może powstać wolny kwas solny. Dla otrzymania takiego wyniku potrzebne stężenie chloru wyżej od 25/M3. W takich wypadkach w płucach zauważono nagromadzenie typowych kryształów chlorku talu, które łatwo ustalić przy badaniu mikroskopowem, lub osad błękitu pruskiego, tworzącego w tkance płuc wyraźne plamki. W razie mniejszego stężenia odczynnik Fitzgeralda daje bronzowo-żółte plamki wskutek powstania Fe(OH)3.
W takich wypadkach zabarwienie płuc jest niezwykłe już wskutek rozkładu hemoglobiny krwi, która tworzy bronzową kwaśną hematinę lub nawet heminę, jej pochodne chlorowane. Następnie te bronzowe barwniki podlegają obezbarwieniu wskutek działania HClO i przybierają brudno-zielonawy a nareście żółty kolor. Odpowiednie zmiany barwniku krwi dają się łatwo ustalić przez badania spektroskopiczne.
Chociaż działanie chloru na ustrój było badane oddawna — istota tego działania nie jest jeszcze dokładnie wyjaśniona. Należy najpierw zwrócić uwagę na stare poglądy Binca, który doszedł do przekonania, że wszystkie chlorowce mają znaczenie środków narkotycznych. Jest jeszcze rzeczą zupełnie nieustaloną czy działanie Cl polega, jak w użyciu innych środków narkotyzujących, mających właściwości ciał chemicznie biernych, tylko na zjawiskach przeładowania, nasycenia chlorem lipoidów komórek nerwowych, czy też na powstawaniu przetworów chlorowanych przez dołączenie chloru do związków o podwójnem połączeniu C albo wogóle przez chlorowanie składników ustroju. Podkreślić należy, że mózg rzeczywiście zawiera wolny chlor, łatwy do określenia zapomocą odczynu ze skrobią i jodkiem potasu, jeszcze wówczas gdy w innych tkankach już go zupełnie brakuje.
Po drugie wiadomem jest, że chlor, działając na wodę, daje kwas solny i wraz z nim czynny tlen.
Nagromadzenie w ustroju kwasu solnego musi wywołać zjawiska tak zw. acidozy, czyli powiększenia stopnia kwasowości krwi ze wszystkiemi następczemi zmianami. Przeciw takiemu przypuszczeniu przemawiają jednak następujące okoliczności, że 1) kwas solny jest znacznie mniej jadowity niż chlor (mniej więcej 30 razy). Do zabicia psa trzeba na kg nie mniej od 2,0 kwasu solnego wprowadzonego dożylnie, wówczas gdy śmiertelna dawka Cl2 przy wdychaniu waha się około 0,008 — 0,06. 2) Bardzo nieznaczną jest zmiana stężenia jonów wodoru w zatruciu chlorem (w normie pH=7,4 po zatruciu Cl2 — 7,25), i ta nieznaczna różnica znika po usunięciu ze krwi CO2, zapomocą prądu powietrza. O pewnym stopniu acidozy, którą organizm jest w stanie całkiem zrównoważyć, wnioskujemy ze znacznego wzrostu kwaśności moczu i zawartości znaczniejszych ilości kwasu solnego w soku żołądkowym, co wywołuje nawet u zatrutych chlorem ataki bólów żołądka.
Częściowo skutkiem tej acidozy, częściowo zaś skutkiem bezpośredniego działania na procesy chemiczne w tkankach, prawdopodobnie w zależności od działania czynnego tlenu, powstają niewątpliwie zmiany w przemianie materji. U wszystkich jednostek, zatrutych dawkami chloru nie powodującemi śmierci, mamy stale wyraźne podniesienie wydzielenia N, dwa razy większe w porównaniu z okresem, poprzedzającym zatrucie.
Przyczyną natychmiastowej śmierci mogą być miejscowe zmiany w płucach (przedewszystkiem ich obrzęk) i zmiany krwi; znaczna anhydremja i powiększona krzepliwość, która jest źródłem powstania niebezpiecznych zakrzepów (najczęściej w żyłach nóg) powodujących następnie zgorzelinę.
Wśród klinicznych postaci zatrucia chlorem i innemi związkami tej grupy, najważniejszemi są następujące.
1) Śmierć natychmiastowa lub w ciągu kilku minut po działaniu stężenia wyższego niż 0,1% (10,0)M3 dla ludzi i od 0,5% (50) M3 dla zwierząt. W pewnej nieznacznej ilości przypadków mamy tu śmierć wskutek skurczu głośni, zwykle jednak jest ona wywołana nagłym rozkładem krwi wskutek powstania pod wpływem HCl kwaśnej hematyny. Badanie pośmiertne wykazuje w tych razach niezwykłe zabarwienie płuc, które są usiane bronzowemi, zielonemi i żółtemi plamami. Natomiast obrzęk płuc i zjawiska zapalenia nie występują wyraźnie z powodu szybkiej śmierci.
2) Ostre zatrucia, wywołujące śmierć w ciągu 20 — 30 minut po kilku godzinach (do 2 — 3 dni) po zatruciu, następują po działaniu stężenia 6/M3 do 10/M3. Najważniejszym objawem tej postaci zatruć jest ostry obrzęk płuc z następną anhydremją, do których dołączają się zwykle objawy osłabienia serca. Kliniczne objawy polegają przedewszystkiem na męczącej duszności. Objawy zapalne występują dość wyraźnie w długotrwałych przypadkach, przeważnie w górnym odcinku dróg oddechowych.
3) Podostre zatrucia, obserwowane u oporniejszych jednostek w tychże lub nieco słabszych stężeniach. Z początku występują tu dość wyraźne objawy podrażnień śluzówki oczu, nosa i gardzieli, do których prędko dołącza się silny nieżyt, a następnie tworzenie się w gardzieli i jamie nosa błon rzekomych, jak w błonicy. Nieżyt rozpowszechnia się następnie na oskrzela, a w płucach powstaje zapalenie zrazikowe z początku toksyczne, a później o charakterze bakteryjnym. W niektórych przypadkach obserwowano zgorzel płuc. Bardzo często tworzy się rozszerzenie oskrzeli.
W czasie wojny chlor był używany sam przez się lub z dodatkiem pewnych substancyj, jak fosgen (50%) i chloropikryna, do tworzenia fal gazowych. Do tego celu służyły duże stalowe butle napełnione płynnym chlorem, używane w czasach pokoju do przewożenia i przechowywania tego odczynnika. Chlor należy do stosunkowo łatwo skraplających się gazów.
Ujemną cechą chloru jest to, że wskutek swojej wyraźnej czynności chemicznej jest on trucizną bardzo łatwą do zwalczania. Nawet wilgotna chustka jest już w pewnym stopniu skuteczną obroną. Maski z kilku warstw muślinu, zwilżonego rozczynem tiosiarczanu sodu z dodatkiem węglanu sodu i gliceryny, używano już w pierwszym czasie powstania wojny gazowej. Tiosiarczan sodowy Na2S2O3 rozkłada się w obecności chlorowców według wzoru:
t. j. powstaje sól kuchenna i sodowa sól kwasu tetrationowego. Teraźniejsze maski z aktywowanym węglem pochłaniają chlor również bardzo łatwo. Do wytwarzania chmury gazowej potrzebną jest olbrzymia masa materjału. Dostarczenie na pole walki dużej ilości bardzo ciężkich butli z chlorem jest niełatwem zadaniem. Prócz tego wyniki ataku są uzależnione od kierunku i siły wiatru i od stopnia wilgoci powietrza. Niema więc nic dziwnego, że gdy użyto chloru, tylko pierwszy atak gazowy ze strony Niemców na zachodnim froncie 22.IV.1915 r. miał rzeczywiście zatrważające wyniki. Z 12.000 Kanadyjczyków, którzy padli ofiarą tego ataku, po upływie 5 dni pozostało przy życiu tylko 2.000. Przeważna część była zabita natychmiast. Drugiego takiego ataku nie udało się już dokonać aż do 19.XII.1915 r. Użyto wtedy jeszcze niebezpieczniejszej mieszaniny chloru i fosgenu, lecz skutki ataku dzięki użyciu masek były znacznie mniej przerażające. Prawdopodobnem jest, że w pierwszym ataku Niemcy użyli na każdy krok swego frontu nie mniej niż jeden cylinder zawierający 40 — 45 funtów płynnego chloru, który nagle wyrzucono w przeciągu kilku minut.
Innych środków, należących do grupy chloru, a również pochodnych kwasu siarczanego, nigdy nie używano w takich rozmiarach. Technika ataku gazowego podległa później znacznym zmianom, dzięki użyciu pocisków gazowych; dla tego celu jadowitość chloru jest niewystarczająca, wskutek czego ma on obecnie już tylko znaczenie historyczne.
Wśród współczesnych środków duszących na pierwszy plan występują fosgen i inne związki tej grupy.
O znaczeniu grupy fosgenu dla celów wojennych można wnioskować z tego, że Niemcy użyli w czasie wojny 10682 tonn fosgenu i 15616 tonn palitu. We Francji ilość otrzymanego fosgenu osiągła 15800 tonn. Zakład w Edgewood wyrabiał aż do 40 tonn codziennie i za krótki czas jego czynności było dostarczono dla wojska 1616 tonn. Superpalit w większych ilościach wyrabiali tylko Niemcy. Produkcja jego osiągała 600 tonn na miesiąc.
Zasadniczą właściwością chemiczną tej grupy jest zdolność do odszczepiania pod wpływem wody kwasu solnego. Są one wszystkie tak zwanemi chlorobezwodnikami kwasów organicznych: węglowego i mrówczanego. Pochodne wyższych homologów kwasów tłuszczowych (np. kwasu octowego) mają mniej wyraźne właściwości trujące.
Kwas węglowy
| CO< | OH OH |
Węglan dwumetylowy
| CO< | OCH3 OCH3 |
Chloropochodne węglanu dwumetylowego
| CO< | OCH2Cl OCH3 |
| CO< | OCHCl2 OCH3 |
| CO< | OCCl3 OCH3 |
| CO< | OCCl3 OCH2Cl |
| CO< | OCCl3 OCCl2 |
| CO< | OCCl3 OCCl3 |
(najważniejsza domieszka superpalitu)
| CO< | O—CH2Cl O—CH2Cl |
| CO< | O—CHCl2 O—CHCl2 |
| CO< | O—CHCl O—CHCl2 |
| CO< | OCH2Cl OCCl3 |
| CO< | OCHCl2 OCCl3 |
| CO< | Cl Cl |
Kwas mrówczany
| CO< | H OH |
Kwas chloromrówczany
| CO< | Cl OH |
Chloromrówczan metylu
| CO< | Cl OCH3 |
Chloromrówczan chlometylu
Palit. K Stoff
| CO< | OCH2Cl Cl |
Chloromrówczan trójchloru metylu. Superpalit Dwufosgen
| CO< | Cl OCCl3 |
Kwas octowy
| CO< | OH CH3 |
Kwas dwuchlorooctowy
| CO< | CHCl2 OH |
Dwuchlorooctan etylu
| CO< | CHCl2 OC2H5 |
Czynność ich zależy od obecności grupy —CO—Cl.
Przy działaniu na fosgen wody mamy następną postać rozkładu
Chlorobezwodniki są wogóle bardzo czynnemi związkami i łatwo reagują z całym szeregiem innych substancyj jak np. z amoniakiem i jego pochodnemi, z alkoholami i t. d.
Tak np. fosgen tworzy z suchym amoniakiem mocznik: COCl2 + 2NH3 = CO(NH2)2 + 2HCl, z dwumetylfenilaminą — benzofenon.
| 2.(CH3)2C6H3NH2 + COCl2 = 2 HCl + CO< | C6H3(CH3)2 C6H3(CH3)2 |
z aldehydami reaguje on w taki sposób
| O ‖ | ||||||
| R—C | / H \ O |
+ C | / Cl = O \ Cl |
= R—C | / O—C—Cl — Cl \ H |
I tak z chloralu według wzoru: CCl3COH + COCl2 = CCl3—CHCl—O—COCl powstaje C3Cl5HO2
W taki sposób mogą łatwo powstać duże cząsteczki złożonej budowy. W związku z tem zwracamy uwagę, że zastępując chlor przez brom i tlen przez siarkę otrzymujemy podobne związki: bromfosgen COBr2 i tiofosgen CSCl2, wogóle bardzo niestałe i znacznie mniej trujące.
Fosgen, palit i superpalit są najniebezpieczniejszemi ze wszystkich środków duszących. Były one w dalszym ciągu wojny gazowej używane w dużych ilościach do napełniania specjalnych pocisków (niemieckie pociski z białą literą D); do tych celów najlepiej nadawały się płynne pochodne kwasu chloromrówczanego (pociski z zielonym krzyżem u Niemców zawierające superpalit) i z białą literą C (palit albo KStoff). Z tych pocisków pociski białe C zawierały czysty superpalit, a pociski z zielonym krzyżem: 1) superpalit i chlorek fenilkarbylaminy, 2) mieszaninę superpalitu z 35% chloropikryny, 3) superpalit, fosgen i dwufenylochoroarsinę.
Jadowitość fosgenu jest rzeczywiście bardzo znaczna. Zajmuje on co do jadowitości w szeregu środków użytecznych do zatruwania powietrza drugie miejsce, na pierwszem miejscu stoi kwas pruski, który w warunkach doświadczeń laboratoryjnych zabija psy i króliki natychmiast już w stężeniu 0,1/M3 = 1(10-7). Dla fosgenu mamy 0,25(M3) = 25(10-8) (Mayer). Według innych badaczy mamy dane następujące: stężenie 0,02(M3) = 2(10-8) jest już nie do wytrzymania dla ludzi; w stężeniu 0,05(M3) = 5(10-8) obserwowano już śmiertelne wypadki.

Rys. 14.
Krzywa postępowego wzrastania obrzęku płuc w czasie zatrucia fosgenem. Normalny stosunek wagi płuc do wagi ciała jest 8‰ (punktowana linja — równoległa osi odciętych). Rzędne oznaczają zmianę tego stosunku w ciągu pierwszych 6 dób po zatruciu. Stosunek ten podnosi się w ciągu pierwszych 12 godzin aż do 40‰ i następnie powoli obniża się w ciągu 3—6 dób do pierwotnego stanu.
Palit w porównaniu z fosgenem jest mniej jadowity — zabija on króliki w stężeniu nie niższem od 1(M3) = 1(10-6). Psy są znacznie odporniejsze (śmiertelne stężenie od 4(M3), prawdopodobnie to samo odnosi się też do ludzi. Superpalit (dwufosgen, Grünkreutz) nie ustępują co do jadowitości fosgenowi.
Ażeby wywołać zmiany pod wpływem kwasu solnego, powstałego z rozkładu fosgenu, na hemoglobinę krwi, więc tworzenia się kwaśnej hematyny podobnie do tego, co obserwowano w nagłej śmierci w przypadkach zatrucia chlorem, potrzebne są praktycznie nieosiągalne stężenia. Takie zmiany były zauważone tylko u zwierząt zatrutych w komorach gazowych czystym fosgenem.
Zwykłą przyczyną nagłej śmierci, w zatruciu temi środkami ludzi i zwierząt jest nagle powstający, niezwykle obfity obrzęk płuc. Obrzęk ten nigdy nie powstaje natychmiast po zatruciu, lecz potrzebuje do swego rozwoju kilku godzin czasu. Rozwój jego jest prawie że proporcjonalny do liczby ct t. j. zależy zarówno od stężenia jak i od czasu działania. Ponieważ fosgen w trujących stężeniach jest tylko słabo drażniącym, — wywołuje on jednak w stężeniu 0,1/M3 napady kaszlu, kichania, połączonego w pewnych przypadkach z wymiotami, — więc nie można go zaliczyć do gazów niewdychalnych, zarówno dla zwierząt doświadczalnych jak dla ludzi. Na polu walki z początku można zupełnie nie zauważyć obecności trucizny, którą jednak można odczuć dzięki charakterystycznemu zapachowi, podobnemu do zgniłych jesiennych liści albo owoców i dzięki zjawiskom parosmii (zmiana zdolności rozróżniania zapachów, np. wstręt do tytoniu u palących). Znane są przykłady niespodzianego zatrucia całych plutonów, które nie dostrzegły niebezpieczeństwa.
Długotrwałe działanie nieznacznych stężeń albo znaczniejsze stężenia działające w ciągu kilku minut, powodują po upływie pewnego czasu obrzęk płuc, który prędko wzrasta. Tak w doświadczeniach na kotach (Heitzman) mamy przy ct=450 po trzech godzinach wzrost stosunkowy wagi płuc (stosunek pomiędzy wagą płuc, a wagą ciała) z 8‰ do 12&premil;, po 5 godzinach do 23,5%permil;, a po 10 godzinach dosięga on najwyższego stopnia rozwoju do 40‰. Jeżeli zwierzę przeżyje ten okres, następuje powolne wchłanianie płynu w ciągu 2 — 3 dni. Skład płynu obrzękowego jest podobny pod względem zawartości białka do osocza krwi. Dlatego powstawanie obrzęku nie powoduje anhydremji, a tylko polyglobulje, t. j. we krwi wzrasta stosowna ilość krwinek bez powiększenia stężenia osocza. Zależnie od zmian właściwości krwi, także w pewnym stopniu wskutek bezpośredniego działania trucizny na mięsień serca powstaje ostre rozszerzenie serca, słabość jego i wreszcie porażenie. Porażenie to może nastąpić po upływie kilku dni albo tygodni po zatruciu i jest zwykłą przyczyną śmierci odległej. Dlatego na sekcji ludzi i zwierząt zatrutych fosgenem albo palitami znajdujemy zwykle serce w stanie wyraźnego rozkurczu, przepełnione krwią, zwłaszcza prawa jego komora.
Objawy zapalenia płuc i oskrzeli są obserwowane tylko wyjątkowo jako skutek następnych zakażeń. Bardzo wyraźną jest chroniczna rozedma, wskutek utraty elastyczności tkanki płucnej.
Sposób toksycznego działania trucizn tej grupy jest bardzo mało wyjaśniony. Istniały co do tego następujące cztery teorje.
Teorja acidozy, opierająca się na powstawaniu podczas hydrolizy fosgenu kwasu solnego. Oczywistem jest, że ponieważ kwas solny, nawet po bezpośredniem wprowadzeniu do krwi jest 800 razy mniej jadowity niż fosgen, niema mowy o takiej bezpośredniej acidozie, której objawy zresztą są zupełnie inne. Wskutek tego przypuszczano, że mamy tu do czynienia z wewnątrzkomórkową acidozą. Trucizna rozpuszczalna w lipoidach komórki przenika do jej wnętrza i rozkładając się na kwas solny i dwutlenek węgla, zabija żywą zarodź. Takie tłumaczenie nie godzi się z brakiem w tych zatruciach jakichkolwiek wyraźnych objawów martwicy i zwyrodnienia komórek. Jak już podkreślono w zatruciach tych nie spostrzegano żadnego wyraźnego działania na bardzo czuły nabłonek dróg oddechowych. Trzecim możliwym skutkiem acidozy jest zmiana odczynu tkanki i jej właściwości koloidalnych. W tych warunkach zmienia się jej zdolność do pochłaniania wody i powstaje typowy obrzęk. Jednak w obrzęku fosgenowym mamy nie nagromadzenie wody w tkankach płuc, a naodwrót występowanie z naczyń osocza krwi bez jakichkolwiek znaczniejszych zmian zwykłego stężenia krwi i płynu tkankowego. Brak jakichkolwiek zmian w odczynie moczu i zawartości jonów H we krwi też trudno połączyć z przypuszczeniem acidozy.
Druga teorja polega na przypuszczeniu zatrucia tlenkiem węgla powstałym przez rozkład fosgenu we krwi, odwrotnie do jego syntezy, według wzoru COCl2 = CO + Cl2. Taki rozkład jest mało prawdopodobny.
Obecność CO byłaby bardzo łatwa do ustalenia ze zmiany widma hemoglobiny, nie mówiąc już nawet o tem, że objawy zatrucia czadem nie mają nic wspólnego z objawami zatrucia fosgenem. Również trzeba zwrócić uwagę, że próg napastliwości dla CO jest 0,6/M3 gdy dla fosgenu 0,05/M3.
Trzecia teorja polega na przypuszczeniu istnienia bezpośredniego połączenia fosgenu z białkiem. Hydroliza fosgenu ostatnio nie odgrywa poważnej roli podczas jego rozkładu w ustroju, o ile chodzi o stężenie słabe, używane zazwyczaj, a reakcja krwi nie zmienia się przez przepuszczanie prądu zatrutego powietrza nawet in vitro. W takich warunkach następuje inne bardzo ciekawe i mało zbadane zjawisko: 98% fosgenu zawartego w powietrzu znika podczas przepuszczania przez krew bez jakichkolwiek zmian we właściwościach hemoglobiny i bez powstania bliżej określonych pochodnych. Tylko po dłuższym okresie działania i pochłanianiu wielkich ilości COCl2 powstaje powoli zmiana odczynu na wyraźnie kwaśny i tworzenie się kwaśnej hematyny. Krew, która pochłonęła kilka bezwzględnie śmiertelnych dawek fosgenu, okazuje się przy dożylnem wstrzyknięciu zupełnie obojętną. Zjawisko to nie jest jeszcze dokładnie zbadane, możemy jednakże z niego wywnioskować, że fosgen w ustroju ulega prócz hydrolizy innym zmianom, które następują nawet wcześniej niż hydroliza. Znana jest zdolność białka, wynikająca z jego oddziaływania dwoistego (odczyn amfoteryczny), do pochłaniania znacznej ilości zarówno kwasów jak i zasad, a z drugiej strony łatwość powstawania przez połączenie fosgenu z grupami NH.CO.NH;−C.CO.C.;NH−CO.C= podwójnych cząsteczek, podobnie do omówionego wyżej powstawania benzofenonów. Takie odczyny są bardzo prawdopodobne dla białka i mogą wywołać powstanie nowych ugrupowań jego molekuł, niezdolnych do wykonania zwykłych odczynów życiowych. W takim razie fosgen miałby właściwości porażającej trucizny komórkowej. Podstawy tej teorji ogłosił w roku 1922 prof. Wojnicz Sianożęcki.
Ostatnią możliwością tłumaczenia działania fosgenu jest tak zw. działanie cząsteczkowe, więc niezależne od rozkładu. Jednak katalityczne działanie nie było dotychczas ustalone, a miejscowe działanie na płuca wobec braku jakichkolwiek ogólnych objawów czynią takie przypuszczenie mało prawdopodobnem. Będąc w stanie, dzięki rozpuszczalności w lipoidach, przeniknąć do wnętrza komórek, fosgen ulega zniszczeniu już w pierwszych dostępnych dla niego komórkach. Dlatego za podstawę wszystkich objawów zatrucia temi środkami przyjmujemy, jako najprawdopodobniejsze, miejscowe funkcjonalne uszkodzenie nabłonka pęcherzyków płuc.
Co do ogólnych właściwości trucizn, należących do tej grupy, to trzeba zanotować następujące dane:
1) fosgen (collongite u Francuzów) w zwykłej temperaturze (15 — 20C°) jest bezbarwnym gazem 3,5 raza cięższym od powietrza. W T° -8°C i ciśnieniu 760 mm tworzy się z tego gazu bezbarwny płyn. Otrzymują go zwykle przez bezpośrednie połączenie czadu i chloru CO−Cl2 = COCl2, używając węgla jako katalizatora, lub przez działanie na chlorek węgla CCl4 bezwodnika kwasu siarczanego, t. zw. oleum, albo dymiącego kwasu siarczanego według wzorów.
CCl4 + 2SO3 = COCl2 + S2O5Cl (chlorek pirosulfurylu). CCI4 + H2S2O7 = COCl2 + SO2Cl2 (chlorek sulfurylu).
Ostatni sposób był używany z początku we Francji, teraz go zupełnie zaniechano.
Znaczne ilości fosgenu wytwarzają się podczas spalania tak zw. mieszaniny Berger’a, składającej się z 48% C2Cl6; 47% KClO3 i 5% C. Powstający stąd dym zawiera 40,6% fosgenu i 20% czadu, 32% CO2 i pewne ilości HCl i Cl2.
2) Palit ClCOOCH2Cl chloromrówczan chlorku metylu stanowi bezbarwną ciecz z ciężarem gatunkowym 1.236 i punktem wrzenia +71,4°C. Łatwo paruje. Para ma swoisty drażniący zapach inny niż fosgen. W ustroju rozkłada się z powstaniem aldehydu mrówczanego.
3) Superpalit (Perstoff u Niemców) chloromrówczan trójchlorku metylu albo dwufosgen ClCOOCCl3 jest bezbarwną cieczą, z punktem wrzenia +128°C. Jest on znacznie mniej zdolny do hydrolizy i dlatego trwalszy od fosgenu i palitu.
Palit i superpalit otrzymują się przez chlorowanie mrówczanu metylu HCO2CH3 lub przez działanie fosgenu na alkohol metylowy według wzorów.
COCl2 + CH3OH = ClCO.OCH3 + HCl
ClCOOCH3 + 3Cl2 = ClCOOCCl3 + 3HCl
ClCOOCH3 + Cl2 = ClCOOCH2Cl + HCl
Dość liczne inne związki tej grupy omówione wyżej, nie są tak jadowite i do celów bojowych nie były używane. Pochodne kwasu węglowego są prawie obojętne.
Trzy następne grupy (C, D, E) środków oddechowych obejmują takie substancje, które oprócz działania na narządy oddechowe mają jednocześnie i inne właściwości, dzięki którym można je przenieść również do innych zasadniczych grup.
Tak np. chloropikryna ma wyraźne właściwości drażniące i dlatego można byłoby zaliczyć ją do trucizn odruchowych, chociaż jest ona najsłabszym z tych środków (próg wrażliwości według Fries’a i West’a — 0,019/M3, gdy dla kamitu mamy = 0,0003/M3). Ma ona jednak w tych stężeniach już wyraźne właściwości trucizny, wywołującej zapalenie narządów oddechowych. Należąca do tejże grupy akroleina, będąc gazem silnie trującym, wywołuje podrażnienie i odpowiednie odruchy (łzawienie) w stężeniu 0,075/M3. Grupa tlenków azotowych niezależnie od tego, że posiada właściwości środków duszących, chociaż słabo uwydatnione, ma szczególne wyraźnie działanie na naczynia krwionośne, wywołując ich porażenie.
Trucizny tego rodzaju naogół mało używano do świadomych zatruć. Tlenków azotu (NO2) używano w Niemczech jako domieszki do chloru tylko w pierwszym okresie walki gazowej. Mają one jednak bardzo ważne znaczenie jako jeden ze składników gazów, powstających podczas spalania środków wybuchowych. Zawartość ich całkowicie zależy od warunków spalania i wzrasta wraz z obniżeniem szybkości spalania. W odpowiednich warunkach, podczas spalania piroksyliny może powstać aż do 9% NO2; podczas spalania przetworów nitrogliceryny (dynamitów) do 4,2%, podczas spalania preparatów kwasu pikrynowego (lydditu, melinitu, szimozy) do 40% i trotylu do 30%. Skutki działania na narządy oddechowe są podobne do działania chloru; należy jednak zauważyć, że niebezpieczne następstwa występują nie natychmiast, a dopiero po upływie dość długiego okresu wylęgania.
Bardzo ważnemi, ale jeszcze prawie niezbadanemi z punktu widzenia toksykologicznego są właściwości dymów bojowych. Dymami nazwano suspensje bardzo małych (o średnicy 10-3 — 10-9 cm) cząsteczek stałych ciał (pyłu) w powietrzu; podobne suspensje płynów tworzą mgły. Powstają one skutkiem albo rozpylania mechanicznego, np. podczas wybuchów, albo termicznego, powstałego przez działanie ciepła (jak sublimacja i parowanie) przy następującem ochłodzeniu, albo nareszcie chemicznego, gdy twarde albo płynne cząsteczki tworzą się przez połączenie chemiczne dwóch albo więcej związków, znajdujących się w stanie par w powietrzu.
Pod względem działania na ustrój takie dymy mogą odgrywać rolę wyłącznie mechaniczną, wywołując tak zw. pylice płuc. Do tego mechanicznego działania może dołączyć się pewne chemiczne działanie, zależne od właściwości rozpylonej substancji.
Zależnie od tego dzielimy odpowiednie środki bojowe na dymy obojętne, których cechą jest zupełny brak działania chemicznego, dymy albo raczej mgły żrące, zawierające drobne kropelki kwasów nieorganicznych i dymy trujące, których składnikami są pewne trucizny oddechowe lub inne trucizny o wyraźnem działaniu ogólnem jak fosgen i kwas arsenawy.
Obojętnemi są dymy, w których składnikiem rozpylonym jest węgiel i takie związki, jak chlorek amonu lub tlenek cynku. Używano ich do maskowania zarówno na morzu jak i na lądzie. Zwykle stosowano w tym celu albo niezupełne spalanie węgla w paleniskach okrętów, albo spalanie szczególnych mieszanin w postaci świec lub w specjalnych przyrządach dymotwórczych. Skład jednej z najbardziej udanych mieszanin, używanych w tym celu, mianowicie obojętnej mieszaniny Bergera, jest taki: pyłu cynkowego 25, tlenku cynku 20, czterochlorku węgla 50, ziemi okrzemkowej 5; albo lepiej: pyłu cynkowego 34,6, czterochlorku węgla 40,8, chlorku amonu 7, węglanu magnezu 8,3, chloranu sodu 9,3.
Podczas spalania obojętnych mieszanin powstaje szary, albo czarny dym, zawierający cząsteczki węgla, chlorku amonu i tlenku cynkowego. Żadna z tych substancyj nie jest trująca, a drażniące właściwości ich są też bardzo słabe. Skutkiem działania takiego dymu może być tylko, tak zw. antrakoza czyli pylica węglowa płuc, chorobliwe wzmożenie stanu, w którym znajdują się płuca wszystkich ludzi.
Obojętność dymów, powstałych wskutek spalania mieszanin, zawierających KClO3 i proszki metalowe, podlega jednak pewnej wątpliwości. U Koberta znajdujemy wskazówkę, że podczas spalania takich mieszanin powstają bardzo jadowite i drażniące tlenki chloru ClO2 i Cl2O4, wywołujące nietylko podrażnienie dróg oddechowych, lecz także objawy zatrucia ogólnego i przykre następstwa w postaci zaćmy (katarakty). W dymie z mieszaniny Bergera znajduje się też i fosgen.
Większej ilości dymów bojowych używano jako jednego ze środków zaczepnych. Dymy powstają przez wybuch pocisków dymowych w terenie, zajętym przez nieprzyjaciela i dlatego mogą zawierać najniebezpieczniejsze trucizny. Są to środki żrące albo trujące.
Najważniejszemi ze środków drażniąco-duszących są środki z grupy chloropikryny. Do tej grupy należą po pierwsze pewne aldehydy, mianowicie bardzo drażniący aldehyd krotonowy i używana przez Francuzów akroleina (papite) CH3CH:CH.COH i CH2:CH.COH. Podobnie, jak wszystkie aldehydy substancje te łatwo polimeryzują się (akroleina daje nierozpuszczalny biały osad disakrylu) i utleniają się i dlatego są mało wygodne do celów bojowych. Żeby zapobiec temu rozkładowi używano pewnych domieszek, mianowicie azotynu amylowego i hydrochinonu. Do nich należy również znana każdemu formalina — aldehyd mrówkowy HCOH mająca, jak wiadomo, wyraźne właściwości drażniące. Działając na ustrój wywołują one wybitne podrażnienie górnych dróg oddechowych, odruchowe zatrzymanie oddechu, łzawienie, kaszel i wymioty. Działanie na oskrzela i płuca jest niemniej wyraźne niż w zatruciu chlorem. W szerszym zakresie używano tylko akroleiny pod nazwą „papite” dla napełniania pocisków.
Szczegóły jej działania na ustrój są jeszcze mało ustalone.
O wiele ważniejszym środkiem jest sama właśnie chloropikryna (aquinite u Francuzów). W przeciwieństwie do bardzo niestałych aldehydów jest ona jednym z najtrwalszych środków bojowych. Dzięki swej trwałości wywołuje ona nietylko dość znaczne zmiany miejscowe, lecz posiada też wyraźne działanie ogólne w pewnej mierze podobne do działania chloroformu (CHCl3); do którego jest ona zresztą bardzo zbliżona ze swej natury chemicznej, będąc nitropochodną chloroformu CCl3NO2.
Chloropikryna była wprowadzona jako trujący gaz przez Włochów w końcu r. 1916. Następnie była ona używana w dużych ilościach jako jeden z najskuteczniejszych środków bojowych zarówno przez Niemców jak i przez sprzymierzonych (aquinite Francuzów, vomiting gaz Anglików, Grünkreuz (mieszanina z superpalitem) Niemców). Chloropikryna była zastosowana również przez wszystkich biorących udział w wojnie w mieszaninach do fal gazowych (mieszanina z chlorem, z siarkowodorem, fosgenem (u Anglików) i (z SnCl4) do pocisków. Zwykle otrzymywano ją przez działanie na kwas pikrynowy (trójnitrofenol) wapna blicharskiego C6H2OH (NO2)3 + 11 Cl2 + 5H2O = 3CClNO2 + 3CO2 + 13HCl (sposób Stenhouse). Powstaje ona też przy działaniu na aceton mieszanin kwasów solnego i azotowego CO(CH3)2 + N2O5 + 3Cl = 2CCl3NO2 + CO2.
Chloropikryna stanowi prawie bezbarwną ruchliwą ciecz, cięższą od wody (c. g. 1,69) wrzącą przy 113°C, lecz mimo to dość lotną. Ciśnienie pary w temperaturze 25°C = 23,87 mm. Z punktu widzenia chemicznego jest ona związkiem bardzo biernym. W wodzie prawie się nie rozpuszcza; według danych francuskich autorów 100 cm3 nasyconego wodnego rozczynu zawiera 0,163 (Bernard) albo 0,125 (Nicoladot) chloropikryny. Niemieccy autorzy uważają ją za praktycznie nierozpuszczalną. Chloropikryna hidrolizie zupełnie nie podlega, lecz powoli rozkłada się z powstaniem substancyj utleniających (odczyn ze skrobią i KJ); rozpuszcza się ona łatwo we wszystkich rozczynnikach organicznych. Stosunek do lipoidów nie jest jeszcze dokładnie ustalony. Według danych autorów francuskich tłuszcze absorbują ją w bardzo nieznacznym stopniu. Ani kwasy ani zasady na nią nie działają. Chloropikryna pali się bardzo trudno. Ze specjalnych odczynów zwrócić trzeba uwagę na powstanie pod działaniem siarczynów krystalicznych związków z całkowitem odszczepieniem chloru, ale z zatrzymaniem grupy NO2.
CCl3NO2 + 3Na2SO3 + H2O = 3NaCl + 3NaHSO4 + CH(NO2)(NaSO3)2.
Odczyn ten służy do ilościowego określania zawartości chloropikryny w powietrzu.
Z innych jej odczynów są ciekawe: 1) powstanie metylaminy przy działaniu kwasu octowego i żelaza metalicznego, 2) powstanie chlorku cyanu przy działaniu chlorku cyny i 3) powstanie guanidyny CNH (NH2)2 przy gotowaniu z alkoholowem rozczynem amoniaku.
Chloropikryna podobnie jak inne pochodne organiczne zawierające chlor, powoduje zielone zabarwienie płomienia gazu świetlnego przy obecności jej pary w gazie zapalonym nad siatką miedzianą.
Hemoglobina w obecności chloropikryny przetwarza się w ciągu kilkudziesięciu minut w methemoglobinę, z której następnie może powstać kwaśna hematyna. Zależy to oczywiście od działania grupy NO2, która przedtem ulega redukcji do NO.
Co do działania na ustrój, to, ze względu na swą stałość, chloropikryna po pierwsze działa nietylko drogą wdychania, lecz również w razie wprowadzenia jej w jakikolwiek inny sposób do organizmu po drugie, wywołuje nietylko miejscowe uszkodzenia ale cały szereg objawów ogólnych.
Należy zwrócić uwagę na to, że ciężkie zmiany w płucach powstają także w razie innych sposobów wprowadzenia (np. dożylnego), prawdopodobnie wskutek wydzielania trucizny z wydychanem powietrzem przez płuca i że zatrucie jest możliwe również przez nieuszkodzoną skórę nawet bez wywoływania jakichkolwiek zmian skórnych.
W obecności pary chloropikryny w powietrzu, zależnie od stężenia, obserwujemy zjawiska następujące:
chloropikryna ma charakterystyczny zapach, który można zauważyć już przy zawartości kilkutysięcznych mg na M3. Zapach ten przypomina zapach ananasów. W znaczniejszych stężeniach chloropikryna działa na rozgałęzienia nerwu trójdzielnego jako środek drażniący. Najczulszą jest spojówka oczu; w stężeniu 0,019 mg na 1 M3 (2/100.000.000), następuje wyraźne łzawienie, podrażnienie śluzówki nosa (zapach ostry), kichanie i kaszel. Dalej dołącza się skurczowe zamykanie powiek, podrażnienie oczu staje się bolesne, nie do wytrzymania i następują odruchowe wymioty, jako skutek podrażnienia gardzieli.
W jeszcze znaczniejszych stężeniach lub po dłuższym czasie działania dołączają się do tych objawów zmiany anatomiczne, zapalenie spojówki, zapalenie krtani i mniej więcej wyraźne zapalenie oskrzeli, nie tak znaczne jak w działaniu mocnego stężenia trucizn grupy chloru, jednak powodujące martwicę górnych warstw nabłonka, t. j. zanik nabłonka migawkowego, obrzęk śluzówki i zatkanie drobnych oskrzeli. Stąd powstaje, nawet po dożylnem dostarczeniu trucizny, właściwa dla działania środków duszących rozedma i niedodma płuc.
Pomimo wyraźnego działania na narządy odruchowe chloropikryna dość łatwo przenika do pęcherzyków płucnych, gdzie wywołuje zmiany podobne do tych, które powstają pod wpływem fosgenu, a więc znaczny stopień obrzęku z wysiękiem zawierającym niezwykle wielkie ilości białka, zgęstnienie krwi wskutek poliglobulji i wad krwioobiegu. Takie zatrucia niezależnie od zwykłych powikłań w postaci np. zakaźnego zapalenia płuc, mogą same przez się wywołać w pewnych przypadkach śmierć w ciągu pierwszych 3 dni po zatruciu.
W takich przypadkach rozwijają się wyraźne ogniska zwyrodnienia w wątrobie i nerkach i zmiany mięśnia sercowego. Serce po śmierci zawsze znajduje się w stanie rozkurczu i we wszystkich narządach występuje wyraźne przekrwienie żylne. Użycie bardzo znacznych stężeń, wyżej 2,9/M3 = (2.10-6), daje objawy ostrych śmiertelnych zatruć; zgon następuje po upływie 3 — 30 godzin. Stężenie od 7,5 — 20,0 na M3 zabija zwierzęta w kilka minut.
Przyczyną nagłych zatruć, kończących się śmiercią są objawy, których nie spotykamy po użyciu niższych stężeń — mianowicie od 2 — 7,5/M3. Jednym z nich jest skurcz mięśni naczyń i serca. Przy sztucznej hematyzacji (przepuszczaniu krwi przez naczynia izolowanego narządu, w danym wypadku płuc) ilość krwi wyciekającej z żyły zmniejsza się nagle do zera, skoro tylko nasycimy krew chloropikryną. W zatruciu zwierząt parą śmierć może nastąpić w ciągu jednej minuty. Na sekcji znajdujemy serce w stanie najwyższego skurczu, komory blade i zupełnie puste, wówczas, gdy przedsionki i płuca są napełnione krwią. Śmierć następuje więc skutkiem paraliżu serca w chwili skurczu. Drugiem zjawiskiem jest ciemne zabarwienie płuc podobnie jak w zatruciu chlorem. Zabarwienie to obejmuje całe płuca lub występuje tylko w postaci mniejszych albo większych plam. Zabarwienie to zależy nie od powstania kwaśnej hematyny, jak w zatruciu chlorem, lecz od tworzenia się methemoglobiny. Obrzęk w wypadkach śmiertelnych w ciągu kilku godzin powoduje powiększenie wagi płuc 5 — 6 krotne w porównaniu z normą; w przypadkach śmierci nagłej obrzęk taki nie następuje.
W zatruciach dawkami nie wywołującemi wyników śmiertelnych, chloropikryna występuje z jednej strony jako substancja nieco drażniąca ośrodki nerwowe a przedewszystkiem korę mózgu, z drugiej strony jako trucizna działająca na przemianę materji. Wywołuje ona mianowicie wyraźne obniżenie tej przemiany.
Co do teorji działania to chloropikryna jest trucizną o wyraźnem działaniu cząsteczkowem i prawdopodobnie większa ilość jej wydziela się z organizmu w niezmienionem stanie, dzięki jej wyjątkowej bierności. Miejscem wydzielania są płuca.
Jadowitość waha się w znacznym stopniu, zależnie od sposobu wprowadzenia. Dla kotów i królików mamy dawki następujące:
| 1) dożylnie: | najmniejsza dawka | 0,01 na kg |
| 2) podskórnie | „ „ | 0,15 „ „ |
| 3) naskórnie | „ „ | 15,0 „ „ |
| 4) drogą pokarmową | nawet „ | 1,5 nie powoduje zatrucia. |
Przy wprowadzeniu przez płuca mamy dość powikłane stosunki, ponieważ ilość wchłanianej trucizny nie da się określić ściśle. Zwrócić uwagę należy po pierwsze na stężenie trucizny w powietrzu, po drugie, na czas działania, ponieważ chloropikryna, dzięki swej trwałości, ma wyraźne zdolności do kumulacji. Z połączenia tych dwóch zjawisk mamy znany wyraz ct.
Stężenie wyższe od 7,5/M3 zabija natychmiast, stężenie wyższe od 2/M3 także zabija ale po pewnym czasie. Stężenia mniejsze od 0,5/M3 są zabójcze tylko w razie dłuższego czasu działania. Co do stężeń umiarkowanie mocnych, dla których właściwie użyteczny jest taki sposób określenia jadowitości, mamy jako zabójcze (w ciągu kilku — 1 — 12 dni) ct leżące pomiędzy 2100 — 125000 mg min.M3.
Działanie chloropikryny na ludzi, według danych laboratorjum w Edgewood, powoduje łzawienie natychmiast już w stężeniu 25.10-9, w 2.10-9 dopiero po pewnym czasie działania. Trujące właściwości leżą poniżej 2/10-6. Stężenie 2,5/M3 jest bezwzględnie śmiertelne. Stąd wynika, że chloropikryna narówni z fosgenem jest najniebezpieczniejszym ze wszystkich chemicznych środków bojowych.
Grupa tlenków azotowych ma mniejsze znaczenie.
Azot tworzy z tlenem cały szereg związków: N2O (gaz rozweselający); NO, NO2; N2O3; N2O4; N2O5. Z tych związków mniej więcej trwałe są tylko N2O, NO NO2(N2O4), szczególnie ostatni. Gaz rozweselający wyraźnych trujących właściwości nie posiada.
NO w obecności tlenu natychmiast utlenia się do NO2. N2O4 częściowo rozczepia się według wzoru 2NO2 = N2O4, a N2O3 rozkłada się na NO2 i NO. N2O5 rozkłada się w następujący sposób: 2N2O5 = 4NO2 + O2. W ten sposób więc powstaje dwutlenek azotu i tlen. Dwutlenek azotu NO2 stanowi czerwono-bronzowy gaz cięższy od powietrza (c. g. 1,626) o bardzo nieprzyjemnym, żrącym zapachu. Wdychanie tego gazu w nieznacznych stężeniach nie wywołuje jednak odruchów i dlatego zaliczyć go do środków niewdychalnych byłoby trudniej niż fosgen. Mimo to jest on dość niebezpieczną trucizną. Charakterystyczną cechą jego działania jest rozwój objawów zatrucia po pewnym okresie wylęgania (zwykle kilkugodzinnym). Zwykłem źródłem zatrucia są gazy powstałe przy wybuchach środków nitrowanych. Trzeba zwrócić uwagę, że większość tych środków sama przez się jest w znacznym stopniu jadowita jak np. nitrogliceryna, trotyl, kwas pikrynowy i że jeszcze jadowitszemi od związków, zawierających grupę NO2, są pochodne kwasu azotawego z grupą O−N=O, jak np. najbardziej typowy azotyn amilowy (amilnitrit). Wszystkie te związki wywołują porażenie naczyń krwionośnych, spadek ciśnienia krwi i śmierć wskutek porażenia serca. Wywołują one również wyraźną methemoglobinemję. Zatrucia tlenkami azotu przebiegają zazwyczaj w sposób następujący: stężenia mocne, bliżej zresztą nieokreślone, mogą natychmiast spowodować duszność, niepokój, kaszel, zawrót głowy, sinicę i zapalenie oskrzeli z wydzielaniem obfitej ilości plwociny zabarwionej na żółto. Do tego dołączają się wymioty, biegunka i upadek sił. W znacznej części przypadków już w ciągu pierwszej doby następuje śmierć.
Zwykle jednak mamy do czynienia ze słabszemi stężeniami, którym zupełnie brak właściwości drażniących. Ludzie w zatrutej atmosferze mogą się znajdować w ciągu kilku godzin. Lecz po upływie 6 — 8 godzin od początku działania, gdy człowiek już oddawna opuścił miejsce zatrute, zupełnie nieoczekiwanie następuje nagły napad duszności, podobny do dychawicy, połączony ze skurczem głośni, męczącem pragnieniem i uczuciem zbliżającej się śmierci. Twarz staje się blada, występuje zimny pot, oczy wychodzą z orbit, mowa staje się przerywana. Od czasu do czasu następują długotrwałe ataki uporczywego kaszlu, do którego zwykle dołączają się wymioty. Wreszcie twarz staje się siną. Przytomność jest zupełna i zanika dopiero w ciągu dalszego rozwoju zatrucia, wzrastającej sinicy i osłabienia oddechu. Krew żylna jest ciemna i lepka. Śmierć następuje w ciągu pierwszych 40 godzin. W nielicznych przypadkach wyzdrowienia mamy właściwe dla methemoglobinemji zmiany moczu i łącznie z niemi zapalenie nerek i żółtaczkę.
Prawdopodobne jest jednak, że do wywołania takich objawów potrzebne są długotrwałe działania dość mocnych stężeń, ponieważ podczas ostatniej wojny pomimo ogromnego użycia trotylu i kwasu pikrynowego masowe zatrucia tlenkami azotu nie były notowane. Możliwe jest, że takie wypadki zatrucia nie były dostatecznie odróżniane od jednocześnie powstających zatruć czadem. W każdym razie pomimo powszechnie przyjętej ujemnej oceny tlenków azotu, jako środków bojowych, zasługują one na dokładniejsze zbadanie toksykologiczne.
Jadowite dymy bojowe, z których składa się ostatnia grupa środków duszących są, jak już zaznaczono, jeszcze bardzo mało zbadane z punktu widzenia toksykologicznego. Pewna część tych dymów należy do trucizn odruchowych — przeważnie sternitów. Inne są źródłem drażniących kwasów, przedewszystkiem solnego, ponieważ zwykłe substancje używane w tym celu są chlorobezwodnikami kwasowemi, rozkładającemi się pod wpływem wody na kwas solny i odpowiedni kwas lub wodorotlenek metaloidowy. W pewnych przypadkach wodorotlenek też jest mocnym kwasem, albo w każdym razie ma wyraźne właściwości żrące. Brak dotychczas zupełnie wskazówek co do działania drobnego pyłu powstającego podczas takiego rozkładu i co do powstania niebezpiecznych pylic płuc. Zagadnienie jest jednak bardzo poważne, ponieważ dymotwórcze substancje mogą być i bywają używane nietylko jako domieszka do prawdziwych trucizn (przy napełnianiu pocisków artyleryjskich) w celu utworzenia dymów w miejscu zajętym przez wroga, lecz i w niemniejszym stopniu do celów maskowania czyli ukrywania w terenie własnego wojska. Dlatego wynalezienie istotnie nieszkodliwych dymów obok dymów trujących jest bardzo pożądane.
Dotychczas do tworzenia dymów bojowych były używane następujące środki.
1) Chlorek cyny SnCl4, rozkładający się stopniowo w wilgotnem powietrzu na kwas solny i wodorotlenek cynowy Sn(OH). Z początku w obecności wody powstają liczne wodziany przejściowe, temperatura podnosi się w znacznym stopniu aż do powstania pary chlorku cyny. Tworzy on gęsty biały dym i był używany w czasie wojny w znacznych ilościach, jako domieszka do chloru, a przede wszystkiem do fosgenu w pociskach („opacite“ Francuzów). Sam przez się chlorek cyny jest ciężkim bezbarwnym płynem, wrzącym w temperaturze 114°C. Ma on wyraźne żrące właściwości, dlatego też był używany jako causticum w starożytnej medycynie. Tlenek cyny SnO2 ma też żrące właściwości. Dlatego wdychanie dymu cynowego prawdopodobnie nie jest obojętne.
2) Chlorek tytanowy TiCl4 też jest bezbarwnym płynem, wrzącym temperaturze 136,4°C i rozkładającym się pod wpływem wody z powstaniem chlorowodorotlenków TiCl,3OH, TiCl2(OH)2, TiCl(OH)3 i wreszcie wodorotlenku Ti(OH)4.
Według istniejących nieścisłych wskazówek ma on posiadać właściwości środka słabo-duszącego. Żadnych danych toksykologicznych o nim nie posiadamy.
3) Chlorek krzemowy SiCl4 — bezbarwny płyn, wrzący w temperaturze 59°C, tworzy pod wpływem powietrza gęsty biały dym z mieszaniny tlenku i wodorotlenku krzemu. Zwykle do chlorku krzemowego dodawano amoniaku celem równoczesnego wytworzenia salmiaku powiększającego nieprzejrzystość dymu. Taka mieszanina wytwarza jedną z najlepszych obojętnych zasłon dymowych. Z zakresu działania tlenków krzemu na ustrój zbadano mniej więcej tylko działanie rozpuszczalnych soli kwasu krzemowego. Wyniki są nieuchwytne. W każdym razie nie posiada on wyraźnych właściwości trujących.
4) Chlorek arsenu AsCl3 — również bezbarwny płyn, wrzący w temperaturze 130°C. Na powietrzu rozkłada się, tworząc pył kwasu arsenawego As2O3, znanej, bardzo czynnej trucizny i kwas solny.
Sam przez się chlorek arsenu ma wyraźne właściwości żrące. Para jego wywołuje podrażnienie spojówki, przekrwienie i obrzęk płuc. Jednak nawet w zatruciu dość znacznemi stężeniami (0,2/M3) śmierć następuje dopiero po upływie kilku dni. Chlorek arsenu był używany w wojsku rosyjskiem celem zapobiegania rozkładowi kwasu pruskiego w pociskach, a we Francji jako domieszka też i do innych środków trujących. Jako dym przesłaniający jest gorszy od omówionych wyżej.
5) Chlorek antymonawy SbCl3 krystaliczna, bezbarwna, oleista masa, która była używana w medycynie za dawnych czasów jako środek żrący. Pod działaniem wody powstaje kwas solny i chlorotlenek antymonu, środek także drażniący. Pod względem jadowitości antymon jest niewiele mniej jadowity od arsenu, ale resorbuje się nieco gorzej. Jako dym bojowy był mało używany.
6) Chlorek fosforu — PCl3. Bezbarwny płyn wrzący w temperaturze 76°C i rozkładający się pod wpływem wody na kwasy solny i fosforawy P/HO/3.
7) Chlorek sulfurylu SO2Cl2 — bezbarwny płyn o charakterystycznym żrącym zapachu, wrzący w temperaturze 69°C. W obecności niewielkich ilości wody rozkłada się na kwas solny i kwas chlorosulfonowy (wybitny środek duszący), w obecności większych ilości wody powstaje kwas siarczany.
SO2Cl2 + H2O = SO3ClH + HCI; SO2Cl2 + 2H2O = 2HCl + H2SO4.
8) Bezwodnik kwasu siarczanego SO3 albo rozczyn jego w kwasie siarczanym t. zw. oleum SO3 jest to płyn bezbarwny, ciężki, wrzący w temperaturze 46°. W temperaturze 15° tworzy on masę twardą z sześciotlenku siarki S2O6. W obecności wody dymi, wytwarzając drobne kropelki kwasu siarczanego. Jest jednym z najlepszych dymów bojowych.
9) Biały fosfor — ciało stałe, łatwo zapalające się na powietrzu nawet samo przez się i wytwarzające gęsty dym z P2O5, który z wodą daje kwas fosforowy P2O5 + 2H2O = 2H3PO4
Fosfor jest najlepszym ze środków dymowych i był używany w czasie wojny w olbrzymich ilościach. Środki 6 — 9 nie wytwarzają w szeregu produktów swego rozkładu ani mocnych trucizn ani drażniących pyłów. Wszystkie one jednak mają tę wspólną cechę, że powstają z nich mocne kwasy mineralne mające zawsze wyraźne właściwości drażniące i żrące. Należy jednak pamiętać, że najczynniejszy z tych kwasów, kwas solny, jest 800 razy mniej trujący niż fosgen i że dla powstania prawdziwej acidozy (ogólnego zatrucia kwasem) trzeba wprowadzić nie mniej od 0,9 HCl na kg żywej wagi psa albo kota (króliki są znacznie czulsze). Człowiek ma prawdopodobnie nie mniejszą odporność niż pies. Takich ilości kwasu solnego powietrze nie zawiera nawet w razie największego stężenia dymów bojowych. Dla człowieka zawartość HCl 00,16/M3 jest już bardzo nieprzyjemna i trudno jest takiem powietrzem oddychać; zawartość 0,50/M3 może już wywołać niebezpieczne powikłanie w narządach oddechowych, a 1,6/M3 jest prawie nie do wytrzymania nawet na krótką chwilę (kilka minut). Mamy w takich wypadkach wyraźne skutki podrażnienia górnych dróg oddechowych.
16) Chlorek chromylu CrO2Cl2 — ciecz czerwonego koloru, wrząca w temperaturze 117°C. Pod działaniem wody rozkłada się na kwas solny i bezwodnik kwasu chromowego. Ten ostatni stanowi mocny środek żrący, a wprowadzony do krwioobiegu wywołuje nawet w niewielkich dawkach śmiertelne zapalenie nerek. Jako dym bojowy jest on mało użyteczny.